Dichte von Ammoniaklösung NH3 (M=17,03g/mol)
Dichte 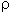 bei 20°C (g/cm³) bei 20°C (g/cm³) |
Gew.% NH3 |
| 0,998 | 0,0465 |
| 0,996 | 0,512 |
| 0,994 | 0,977 |
| 0,992 | 1,43 |
| 0,990 | 1,89 |
| 0,988 | 2,35 |
| 0,986 | 2,82 |
| 0,984 | 3,30 |
| 0,982 | 3,78 |
| 0,980 | 4,27 |
| 0,978 | 4,76 |
| 0,976 | 5,25 |
| 0,974 | 5,75 |
| 0,972 | 6,25 |
| 0,970 | 6,75 |
| 0,968 | 7,26 |
| 0,966 | 7,77 |
| 0,964 | 8,29 |
| 0,962 | 8,82 |
| 0,960 | 9,34 |
| 0,958 | 9,87 |
| 0,956 | 10,405 |
| 0,954 | 10,95 |
| 0,952 | 11,49 |
| 0,950 | 12,03 |
| 0,948 | 12,58 |
| 0,946 | 13,14 |
| 0,942 | 14,29 |
| 0,940 | 14,88 |
| 0,938 | 15,47 |
| 0,936 | 16,06 |
| 0,934 | 16,65 |
| 0,932 | 17,24 |
| 0,930 | 17,85 |
| 0,928 | 18,45 |
| 0,926 | 19,06 |
| 0,924 | 19,67 |
| 0,922 | 20,27 |
| 0,920 | 20,88 |
| 0,918 | 21,50 |
| 0,916 | 22,125 |
| 0,914 | 22,75 |
| 0,912 | 23,39 |
| 0,910 | 24,03 |
| 0,908 | 24,68 |
| 0,906 | 25,33 |
| 0,904 | 26,00 |
| 0,902 | 26,67 |
| 0,900 | 27,33 |
| 0,898 | 28,00 |
| 0,896 | 28,67 |
| 0,894 | 29,33 |
| 0,892 | 30,00 |
Quellen: Chemische Tabellen und Rechentafeln für die analytische Praxis von K. Rauscher (u.a.), weitergeführt von R. Friebe. 8.stark überarbeitete Auflage- Leipzig. Deutscher Verlag für Grundstoffindustrie 1986
Quelle: Merck- Tabellen für das Labor


2 Kommentare
Da fehlt ja ungefähr alles… Einheit. Wie kommst du auf die Werte? Ist das aus einer Messung oder einem Gasgesetz? Bezieht sich das auf Ammoniaklösung oder auf Ammoniakgas?
Autor
Gucken mit Auge! Die Einheiten finden sich in der Kopfzeile. Aus der dortigen Angabe Gewichtsprozent folgt dann auch Ammoniaklösung!